红外光谱解析—氢氧化物
氢氧化物(如 Ca (OH)₂、Mg (OH)₂、Al (OH)₃)因含 - OH 基团,其红外光谱会呈现与羟基相关的特征峰,但由于无机物中金属离子与 - OH 的成键环境(如离子键占比、晶体结构)与有机物差异显著,出峰位置和形态也有明显区别。以下分别介绍三种常见氢氧化物的红外光谱特征:
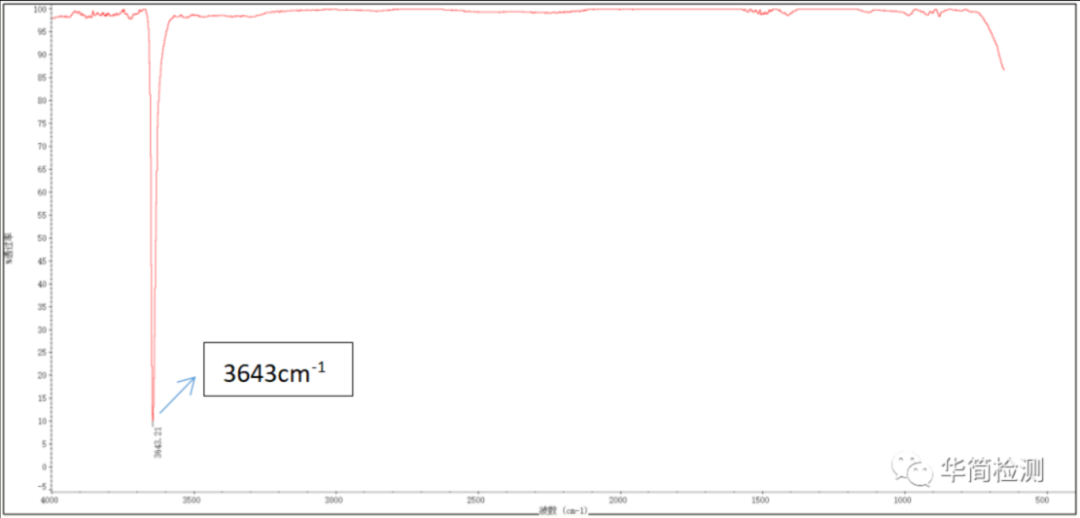
晶体结构:层状结构,Ca²⁺与 - OH 通过离子键结合,层间以弱氢键连接。
特征吸收峰:
3644 cm⁻¹:强而尖锐的吸收峰,对应 - OH 的伸缩振动。因 Ca²⁺离子半径大、电荷低,对 - OH 的吸引较弱,-OH 键能较高,故峰位高于其他氢氧化物。
650-400 cm⁻¹:宽而弱的吸收,源于 Ca-O 键的弯曲振动(指纹区特征)。
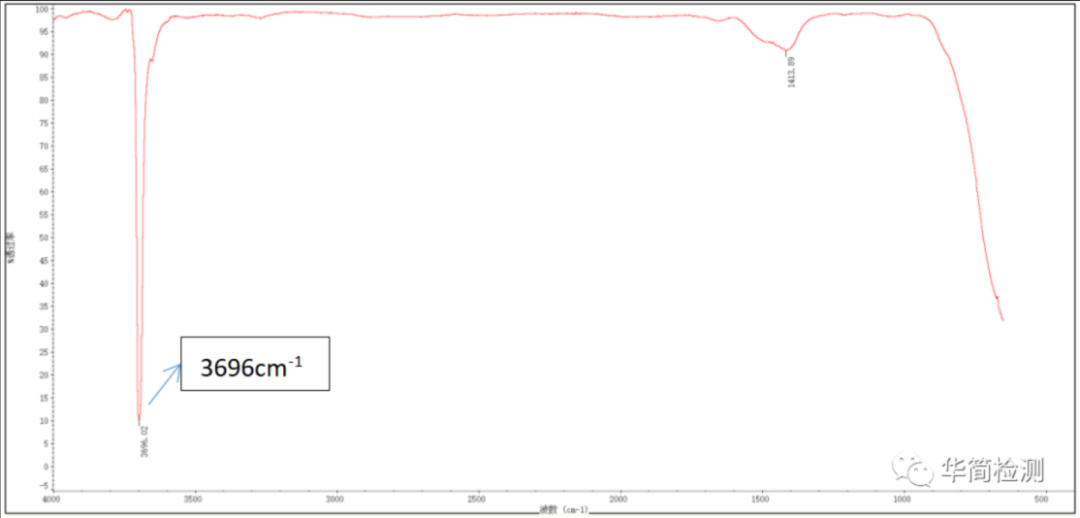
晶体结构:六方层状结构,Mg²⁺离子半径小、电荷密度高,与 - OH 结合更紧密,层间氢键作用强于 Ca (OH)₂。
特征吸收峰:
3698 cm⁻¹:强吸收峰,为 - OH 的伸缩振动。由于 Mg²⁺对 - OH 的吸引力强于 Ca²⁺,-OH 键能略低,峰位较 Ca (OH)₂稍低。
1400-1500 cm⁻¹:弱吸收峰,可能与层间氢键的弯曲振动有关。
400-600 cm⁻¹:较强的宽峰,对应 Mg-O 键的振动及 - OH 的弯曲振动叠加。
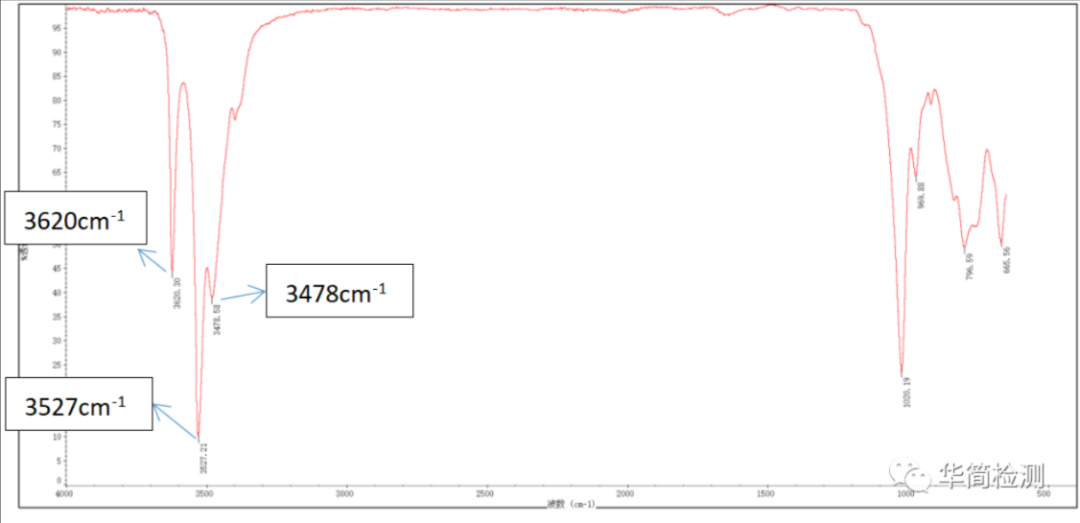
晶体结构:常见为三水铝石结构,Al³⁺与 - OH 形成八面体配位,分子内及分子间存在强氢键,结构较前两者更复杂。
特征吸收峰:
3000-3600 cm⁻¹:宽而强的吸收带,由 - OH 的伸缩振动引起。因 Al³⁺电荷高、对 - OH 吸引强,且氢键作用显著,导致峰形宽化,与有机物中游离羟基的尖锐峰明显不同。
1000-1100 cm⁻¹:中等强度吸收峰,对应 Al-OH 的弯曲振动。
400-800 cm⁻¹:复杂的吸收峰群,源于 Al-O 键的振动及晶格振动,为指纹区的特征标识。
1.出峰位置3500-3700cm-1,这个出峰位置与之前所知的羟基基本一致。
2.相对于有机物中羟基一个大包峰的情况,无机氢氧化物中的-OH出峰基本都是尖峰。因此这可以通过这些特征的出峰对氢氧化物进行判断。
3.除了-OH的特征出峰,基本上其他的出峰都在低波数的指纹区。
4.虽然都是-OH但是根据结构不同,出峰的峰形可以有很大的不同,例如Ca与Mg连接2个-OH就出一个单峰,而Al连接3个-OH结构较为复杂就出了3个峰。
因为在氢氧化物在红外上的出峰位置很高,出峰尖锐而强,因此在对含有无机填料的物质进行分析的时候就可以通过这些位置进行判断。
欢迎关注,共同探讨交流!








